El promedio de la concentración experimental encontrada de NaOH es: ________M.
Nota: Al finalizar la sesión el profesor proporcionará a los estudiantes la concentración real
del hidróxido de sodio empleado como muestra desconocida en la titulación.
Concentración proporcionada por el profesor: NaOH = _________M.
Usar la siguiente ecuación (empleando valores absolutos), para determinar el porcentaje
de error
Nota: recordar que las calculadoras digitales tienen prioridad de operaciones, por ello es
necesario respetar los paréntesis en la fórmula
([C
NaOH(experimental)
- C
NaOH(real)
]
/ C
NaOHl(real)
) x 100
El porcentaje de error en esta titulación fue de: __________%.
Recuperación, reciclado y/o deposición de residuos:
En la sección “Determinación de pH”
- Combinar el contenido de los vasos de precipitados empleados mezclando un ácido y
una base hasta neutralizar. La neutralización sucede cuando en las disoluciones ácidas
por la presencia de azul de bromotimol se torna verde. Una vez neutralizados, confirmando
mediante el uso de potenciómetro, desechar directamente en la tarja.
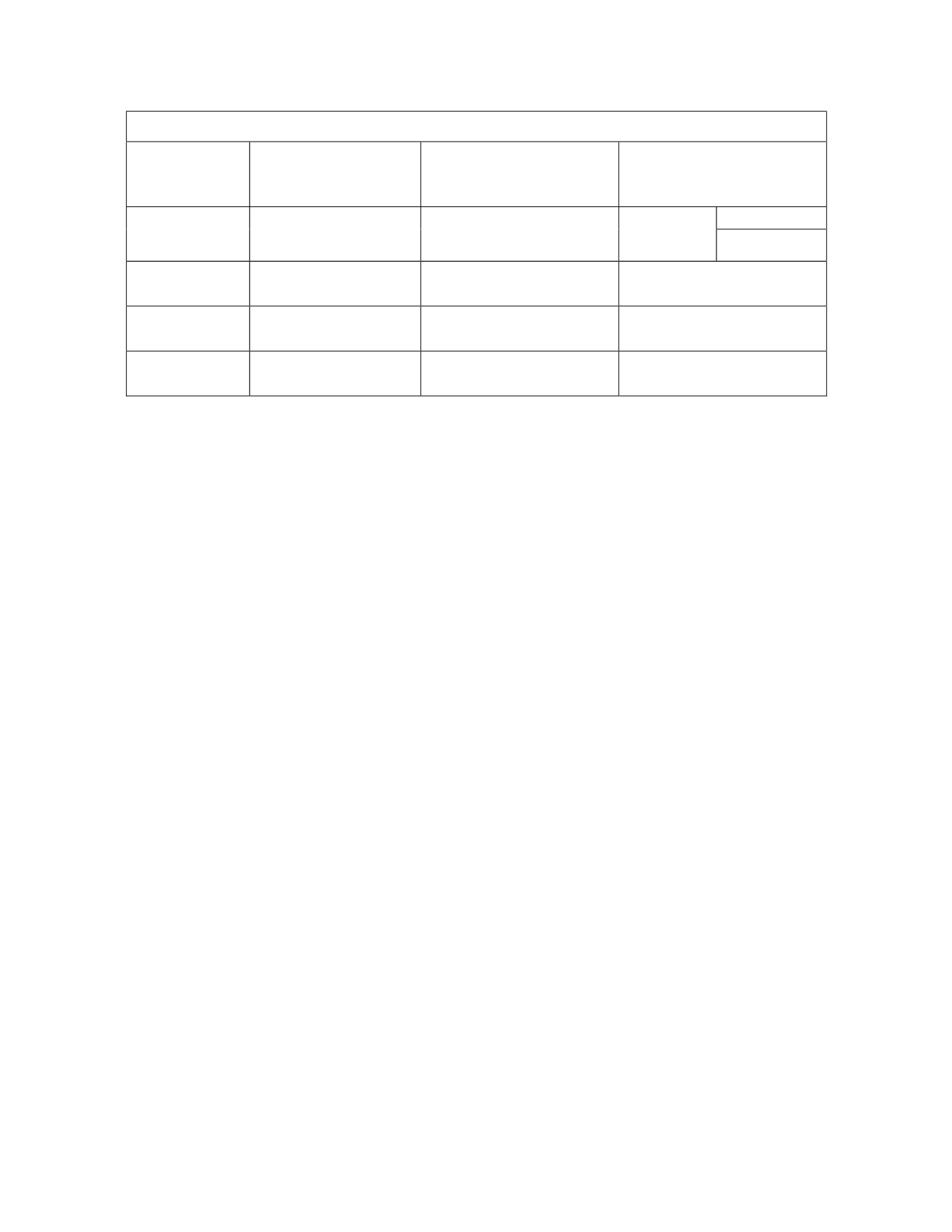
Tabla 3. Determinación de la concentración de NaOH.
C
HCl
(conocida) =
___________ M.
V
HCl
(conocido)
V
NaOH
(conocido)
C
NaOH
(desconocida)
Pruebas
Volumen gastado de
ácido
(mL)
Volumen real de la
muestra básica (mL)
C
NaOH
=
V
HCl
C
HCl
V
NaOH
1
2
3


