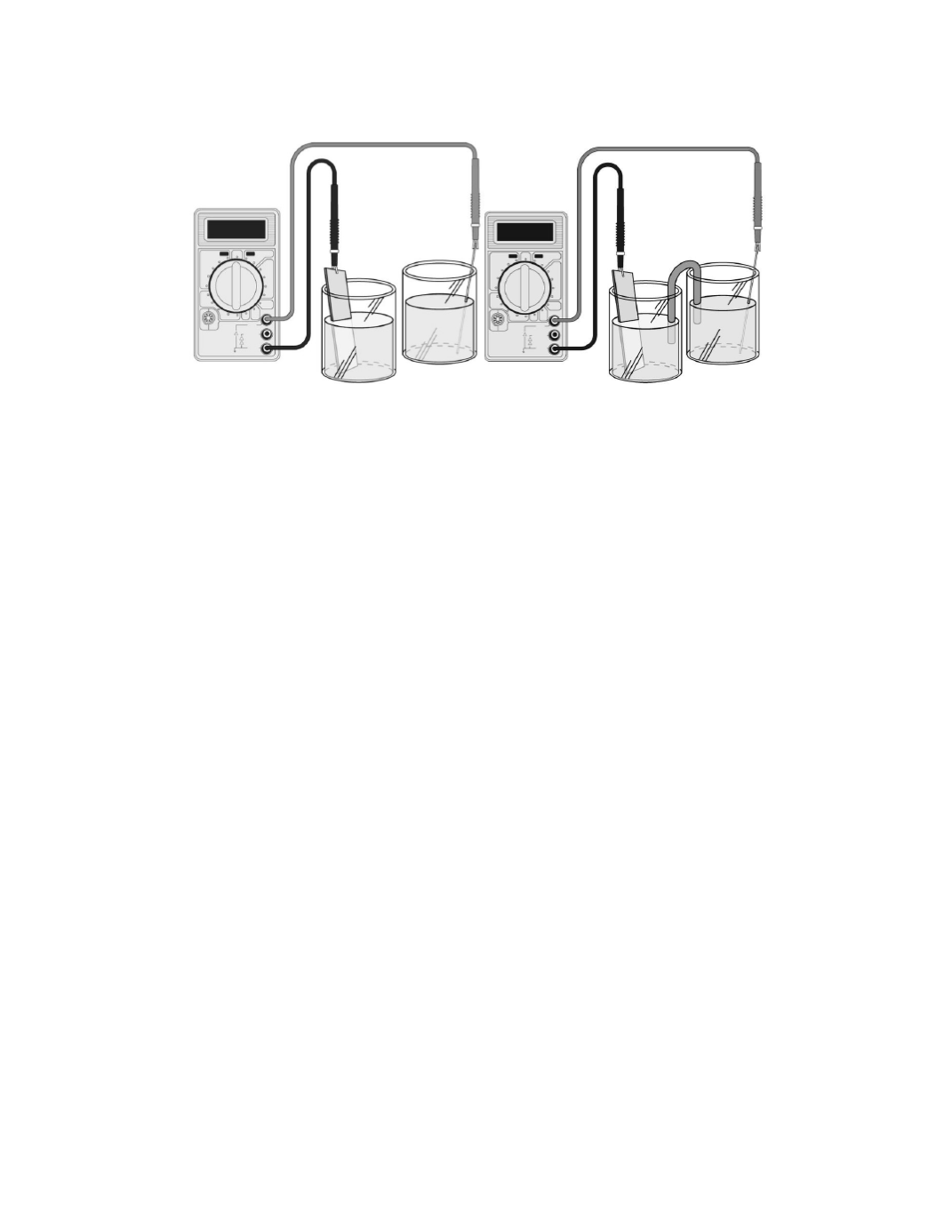
(a) (b)
Figura 2. (a) Representación esquemática de un método para separar agentes oxidantes
y reductores en una reacción redox. (b) Celda galvánica conectada mediante un puente
salino.
La reacción en una celda electroquímica se lleva a cabo en la interfase entre el electrodo
y la disolución donde ocurre la transferencia de electrones. Al electrodo donde tiene lugar
la reducción se le denomina cátodo y al electrodo donde tiene lugar la oxidación se le
denomina ánodo. Una forma de recordar el electrodo donde se lleva a cabo cada semi-
reacción es la regla de CROA,
c
átodo-
r
educción y
o
xidación-
á
nodo.
En la celda galvánica (Figura 2b) se observa que el cátodo aumenta de masa en la
medida que se produce la electricidad y el ánodo disminuye de masa. Dicha celda consta
de un agente oxidante que se encuentra en un compartimiento y que atrae electrones (a
través de un alambre) de un agente reductor que está en otro compartimiento. A la
“atracción” (o fuerza impulsora) sobre los electrones se le llama potencial de celda (ε
celda
)
o fuerza electromotriz (FEM) de la celda. La unidad de potencial eléctrico es el volt (que
se abrevia V), el cual se define como 1 joule de trabajo por coulomb de carga transferida.
En la celda electrolítica las semi-reacciones se invierten por la introducción de trabajo al
sistema, representado por un voltaje o potencial mayor al que genera espontáneamente la
reacción y por lo tanto la masa del cátodo disminuye y la del ánodo aumenta en la medida
que la celda conduce la electricidad.
Baterías
Una batería es una celda galvánica o un grupo de celdas galvánicas conectadas en serie,
en donde los potenciales de cada una de ellas se suman para lograr el potencial total de


